Composicion de sustancias
Composición de la sustancias
- Elementos.- son sustancias puras que no pueden descomponerse en otras como: Fe, S, Pb, Au, Ni y otros.
Los elementos pueden ser:
- Inorgánicos.-son sustancias simples que están clasificados en la tabla periódica.
- Bioelementos.- son sustancias elementales que forman parte de los principios inmediatos y pueden encontrarse en alto grado de pureza en los organismos vivientes.
- Compuestos.- sustancias formadas por la combinación de dos o más elementos.
- Especies Químicas.-son sustancias simples o compuestas que existen en alto grado de pureza en la naturaleza como la sal mineral.
- Principios Inmediatos.-son sustancias complejas de alto grado de pureza y que integran las estructuras celulares.
Naturaleza de la carga Eléctrica
Los protones y electrones crean fuerzas de atracción y de repulsión debido a que estas partículas atómicas tienen una carga eléctrica.
Se puede establecer una ley muy sencilla en relación a las fuerzas de atracción y repulsión entre partículas: las cargas de diferente símbolo se atraen y las del mismo signo se repelen.
La carga de un protón es la misma que la de un electrón, con la diferencia de que la carga de protones es positiva y la de los electrones negativa.
En cambio, los neutrones no tienen carga eléctrica, ni positiva ni negativa. Por lo tanto los neutrones no son atraídos ni repelidos por los protones ni los electrones.
Modelo de Thomson
El modelo de Dalton resultaba insuficiente para explicar la naturaleza eléctrica de la materia: un bolígrafo se carga eléctricamente cuando se frota con lana.
- Joseph Thomson (1856-1940) el físico, Ingles, descubrió en 1897, que el modelo de esfera sólida no era correcto y demostró que en las experiencias descargas en gases se producían partículas con carga eléctrica negativa llamadas rayos catódicos a George J. Stoney denominó electrones.

Descubrimiento del protón
En 1886 Eugene Goldstein utilizó una placa perforada y descubrió que un tubo de rayos catódicos emitía rayos no solo desde el cátodo, sino también desde el ánodo, que tiene carga positiva. Goldstein llamó rayos canales a estas partículas y por su comportamiento supuso que eran de carga positiva. Años más tarde se determinó que estos rayos eran partículas subatómicas de carga positiva llamadas protones.
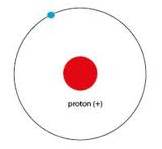
. Modelo de Rutherford
Este modelo fue desarrollado por el físico Ernesto Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911.
Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y otra negativa, en cambio del anterior postula que la parte positiva se concentra en un núcleo, el cual también contiene toda la masa del átomo.
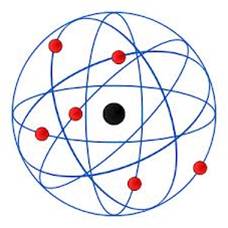
Descubrimiento de los iones
Un ión es un átomo o molécula cuyo número de electrones no es igual al número de protones, dando el átomo de una carga eléctrica neta positiva o negativa.
La palabra ion es el griego “yendo” cuyo término fue introducido por el físico Inglés y químico Michael Faraday en 1834 para la especie entonces-desconocidos que va desde un electrodo al otro a través de un medio acuoso. Faraday no conocía la naturaleza de estas especies, pero sabía que ya que los metales disueltos en solución y se introdujeron en un electrodo y nuevo metal salieron de la solución en el otro electrodo. También introdujo las palabras:
Anión de un ion con carga negativa. Aniones fueron nombrados por su atracción hacia el ánodo.
Catión de un ion con una cargada positivamente. Estos fueron nombrados porque fueron atraídos hacia el cátodo en un dispositivo galvánico.
El átomo nucleario
El núcleo atómico es la parte central del átomo, tiene carga positiva, y concentra más del 99,9% de la masa total del átomo.
Está formado por protones y neutrones que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable. La cantidad de protones en el núcleo determina el elemento químico al que pertenece. Los núcleos atómicos no necesariamente tienen el mismo número de protones, y neutrones, pues átomos de un mismo elemento pueden tener diferentes masas.
Núcleo central: Es muy pequeño en comparación con el volumen total átomo. Es compacto, contiene los protones de carga positiva. Los neutrones, eléctricamente neutros. En el núcleo se concentra casi toda la masa del átomo y es de carga positiva. Corteza envoltura: Aquí se hallan los electrones, de carga negativa, girando en órbitas circulares. La carga del electrón es igual a la del protón pero de signo contrario. Su masa es 1 840 veces menor que la del protón.
Numero atómico de los elementos
. El número atómico (Z) es el número de protones que hay en el núcleo de un átomo de un elemento y es el que determina la identidad de un átomo.
Número atómico (Z) = número de protones (p.) = número de Neutrones (N)= número de Electrones (e-)
Por ejemplo:
El numero atómico (z) del Ca es 20. Lo que significa que tiene 20 protones, 20 electrones y ocupa el vigésimo lugar en la tabla periódica.

